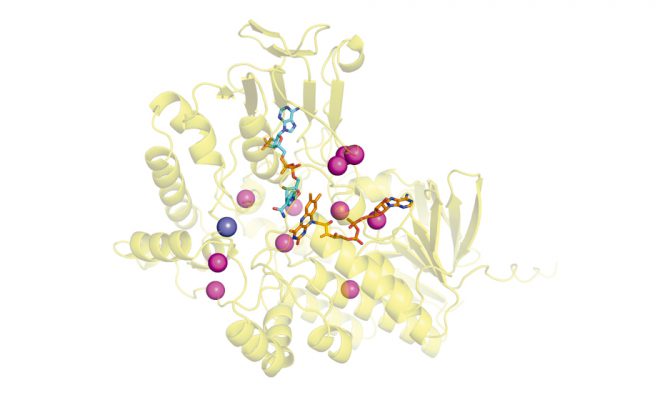
 Modelo estructural de una BVMO ancestral de actinobacteria donde se resaltan los sitios analizados por mutagénesis sitio-dirigida en el trabajo.
Modelo estructural de una BVMO ancestral de actinobacteria donde se resaltan los sitios analizados por mutagénesis sitio-dirigida en el trabajo.
Actualidad
Reconstruyen la evolución de una proteína bacteriana ancestral con potenciales aplicaciones industriales y biotecnológicas
El estudio internacional, liderado por una investigadora del CONICET, aporta nuevos datos para potenciar las aplicaciones productivas de las enzimas BVMOs, capaces de transformar moléculas a partir del uso del oxígeno del aire.
Un equipo internacional de investigación, liderado por una científica del CONICET, reconstruyó la evolución de una familia de enzimas con alto potencial para aplicaciones biotecnológicas: las Baeyer-Villiger monooxigenasas (BVMOs). El estudio, publicado en Cell Reports, no solo determinó en qué momento este grupo de moléculas desarrolló la capacidad de utilizar oxígeno, clave para cumplir sus funciones, sino que, además, abre nuevas vías para comprender el desarrollo de funciones biológicas complejas aportando nuevos datos para potenciar sus fines aplicados.
Las BVMOs son enzimas que toman oxígeno del aire para transformar moléculas mediante un proceso de oxidación. A través de una técnica denominada “reconstrucción de secuencias ancestrales”, que permite conocer, a través del estudio de sus antepasados, cómo una proteína adquiere una determinada función a lo largo del tiempo, el equipo científico reconstruyó su historia evolutiva y detectó en qué momento adquirió la capacidad de utilizar oxígeno.
Según Laura Mascotti, investigadora del CONICET en el Instituto de Histología y Embriología de Mendoza (IHEM, CONICET-UNCUYO) y líder del estudio, estas enzimas existen en los microrganismos desde hace millones de años, mucho antes de que la atmósfera terrestre estuviera enriquecida con oxígeno. “Las BVMOs son proteínas muy ancestrales y su evolución la podemos rastrear con certeza hasta las primeras poblaciones bacterianas, un poco antes del ‘gran evento de oxigenación’, hace aproximadamente 2.5-2.3 millones de años”, dice la científica, recientemente incorporada al IHEM, para establecer un grupo de Bioquímica Evolutiva, luego de varios años de trabajo en los Países Bajos.

Laura Mascotti. líder del estudio.
“Nuestra idea era entender cuándo adquirieron la capacidad de usar oxígeno y cómo. Para ello, lo que hicimos fue aproximarnos al problema desde la bioquímica evolutiva, que en modo simple consiste en estudiar la evolución de la familia de enzimas para poder rastrear en el tiempo cómo fue cambiando una función o cómo la adquirió. Para nosotros es muy importante estudiar esto porque queríamos comprender cómo las monooxigenasas ‘aprendieron’ a usar oxígeno”, agrega la científica.
El estudio demostró que las BVMOs evolucionaron en una serie de pasos, comenzando a partir de una proteína que no tenía actividad y adquiriendo posteriormente reactividad y especificidad hasta transformarse en enzimas activas. En conjunto, los resultados del estudio ilustran cómo un mecanismo catalítico intrínsecamente complejo emergió durante la evolución.
Las BVMOs tienen un alto potencial para aplicaciones biotecnológicas, como la producción de polímeros. Aunque, aún no se han podido utilizar a gran escala debido a su inestabilidad en condiciones operativas y a la necesidad de ajustar su selectividad, en ciertos casos. La ciencia destinada a profundizar sobre su funcionamiento, y el de las enzimas en general, permite mejorar su aplicación práctica. “La bioquímica evolutiva genera resultados que son clave para luego aplicar diseños racionales o semi-racionales de variantes enzimáticas con aplicación industrial porque nos permite conocer y definir cuáles son los ‘determinantes funcionales’ de una enzima. Por otro lado, creo que vale la pena destacar que la reconstrucción de secuencias ancestrales no es una herramienta más de ingeniería genética, sino que es una aproximación para ‘diseccionar/desentrañar’ funcionalidades y que puede generar conocimiento valiosísimo para ser luego utilizado con fines aplicados”, concluye la científica.
Autor: Leonardo Fernández
Fuente: CONICET